étude cinétique en suivant la pression
L'expérience suivante a pour but de déterminer le temps de demi réaction t½ de la réaction entre l'acide chlorhydrique et le magnésium
dont l'équation de la réaction est : Mg + 2H3O+ = H2 + Mg2+ + 2H2O. La transformation est supposée totale.
Dans un ballon on introduit un volume L=10 mL d'une solution concentrée d'acide chlorhydrique (H3O+ ; Cl-)
de concentration C= 8 mol/L. A l'instant initial on plonge un ruban de magnésium de longueur L= 5,1 cm. Très rapidement on ferme le ballon avec un bouchon percé
qui permet de relier, par un tuyau, le contenu du ballon avec un manomètre. On note régulièrement la valeur de la pression indiquée sur le manomètre.
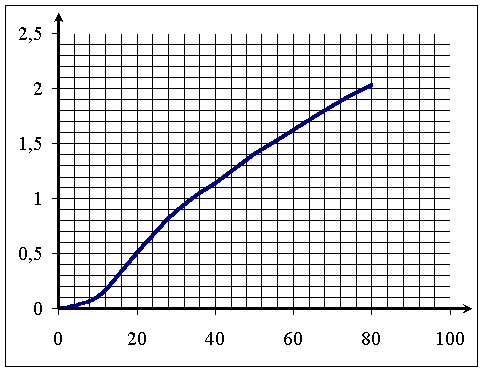
A l'instant initial, la pression dans le ballon est égale à la pression atmosphérique. Au fur et à mesure de la production de gaz la pression
va augmenter. Son expression générale est P= Patm+ P(H2) ou P(H2) est la pression du dihydrogène occupant tout le volume disponible dans le ballon.
Données : masse linéique du ruban de magnésium : l = 1g/m ;masse molaire du magnésium :
24,3 g/mol;
volume du ballon vide : V0 = 100 mL ; Patm= 1,1 105 Pa ; T= 293 K ; R= 8,31 S.I
Suivi de la pression : les résultats obtenus sont rassemblés dans le tableau suivant :